Структурные белки служат в первую очередь в качестве строителей растяжения в клетках и тканях. Обычно они не обладают ферментативной функцией, поэтому обычно не влияют на метаболические процессы. Структурные белки обычно образуют длинные волокна и придают z. B. связки, сухожилия и кости, их сила и подвижность, их подвижность. Несколько различных типов структурных белков составляют около 30% всех белков, встречающихся в организме человека.
Что такое структурный белок?
Белки, которые в основном придают ткани ее структуру и устойчивость к разрыву, обобщаются под термином структурные белки. Структурные белки характеризуются тем, что они обычно не участвуют в ферментно-каталитических метаболических процессах.
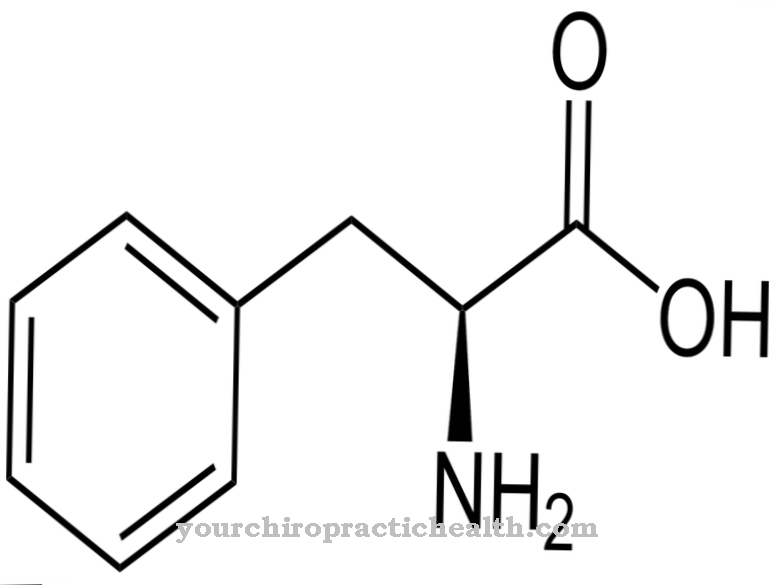
Склеропротеины, которые считаются структурными белками, обычно образуют длинноцепочечные молекулы в виде связанных друг с другом аминокислот, которые связаны друг с другом пептидными связями. Структурные белки часто имеют повторяющиеся аминокислотные последовательности, которые позволяют молекулам иметь особые вторичные и третичные структуры, такие как двойные или тройные спирали, что приводит к особой механической прочности. Важными и известными структурными белками являются z. Б. Кератин, коллаген и эластин. Кератин - один из структурных белков, образующих волокна, которые придают структуру коже (эпидермису), а также волосам и ногтям.
Коллагены образуют самую большую группу структурных белков, поскольку в организме человека присутствует более 24% всех белков. Что поразительно в коллагенах, так это то, что каждая третья аминокислота представляет собой глицин, а последовательность глицин-пролин-гидроксипролин накапливается. Устойчивые к разрыву коллагены являются наиболее важными компонентами костей, зубов, связок и сухожилий (соединительной ткани). В отличие от коллагенов, которые трудно растянуть, эластин придает некоторым тканям способность растягиваться. Таким образом, эластин является важным компонентом легких, стенок кровеносных сосудов и кожи.
Функция, эффект и задачи
Различные классы белков включены в понятие структурный белок. Все структурные белки объединяет то, что их основная функция - придавать структуру и прочность ткани, в которой они находятся. Требуется широкий набор необходимых структурных свойств. Коллагены, которые образуют структурный белок в связках и сухожилиях, чрезвычайно устойчивы к разрыву, поскольку связки и сухожилия подвергаются высоким нагрузкам с точки зрения сопротивления разрыву.
Как компонент костей и зубов, коллагены также должны быть способны образовывать устойчивые к взлому структуры. Помимо сопротивления разрыву, другим тканям тела требуется особая эластичность, чтобы иметь возможность адаптироваться к соответствующим условиям. Эту задачу выполняют структурные белки, относящиеся к группе эластинов. Они могут растягиваться и в некоторой степени сопоставимы с эластичными волокнами ткани. Эластины позволяют быстро регулировать объем кровеносных сосудов, легких, а также различных кожных покровов и мембран, которые окружают органы и должны справляться с изменением размеров органов. В коже человека коллагены и эластины дополняют друг друга, обеспечивая упругость и способность кожи двигать.
В то время как коллагены в связках и сухожилиях в основном гарантируют прочность на разрыв в определенном направлении, кератины, входящие в состав ногтей на руках и ногах, должны обеспечивать плоскую (двумерную) прочность. Другой класс структурных белков состоит из так называемых моторных белков, которые являются основным компонентом мышечных клеток. Миозин и другие моторные белки обладают способностью сокращаться из-за определенного нервного стимула, так что мышца временно укорачивается при использовании энергии.
Образование, происхождение и свойства
Структурные белки, как и другие белки, синтезируются в клетках. Обязательным условием является гарантированная поставка соответствующих аминокислот. Во-первых, несколько аминокислот связаны с образованием пептидов и полипептидов. Эти части белка соединяются на шероховатом эндоплазматическом ретикулуме, чтобы сформировать более крупные части, а затем сформировать полную молекулу белка.
Структурные белки, которые должны выполнять функции вне клеток во внеклеточном матриксе, помечены и транспортируются во внеклеточное пространство посредством экзоцитоза посредством секреторных везикул. Требуемые свойства структурных белков охватывают широкий спектр от прочности на разрыв и эластичности. Структурные белки обычно встречаются только как часть тканей, поэтому их концентрацию нельзя легко измерить напрямую. Поэтому нельзя дать оптимальную концентрацию.
Заболевания и расстройства
Сложные задачи, которые должны выполнять различные структурные белки, приводят к ожиданиям, что также могут возникать сбои, которые приводят к нарушениям и симптомам. Это также может привести к сбоям в цепочке синтеза, поскольку для синтеза требуется большое количество ферментов и витаминов.
Наиболее заметные нарушения возникают, когда соответствующие белки не могут быть синтезированы из-за недостатка аминокислот. Большинство необходимых аминокислот может синтезироваться самим организмом, но не незаменимые аминокислоты, которые должны поступать извне в виде пищи или пищевых добавок. Даже при достаточном поступлении незаменимых аминокислот всасывание в тонком кишечнике может быть нарушено из-за болезней или из-за проглоченных токсинов или как побочный эффект некоторых лекарств и вызвать их дефицит. В данном контексте хорошо известным, хотя и редким заболеванием является мышечная дистрофия Дюшенна.
Заболевание вызвано генетическим дефектом Х-хромосомы, поэтому напрямую страдают только мужчины. Генетический дефект означает, что структурный белок дистрофин, отвечающий за закрепление мышечных волокон скелетных мышц, не может быть синтезирован. Это приводит к тяжелой мышечной дистрофии. Другое, тоже редкое, наследственное заболевание приводит к митохондриопатии. Несколько известных генетических дефектов в ДНК и митохондриальной ДНК могут вызывать митохондрии. Изменение состава определенных структурных белков митохондрий приводит к снижению энергообеспечения всего организма.
.jpg)
.jpg)

.jpg)
.jpg)
.jpg)


.jpg)